Équipe 2 : Conception et Synthèse de Molécules d’Intérêt Thérapeutique – CoSMIT
Les thématiques de l’équipe CoSMIT s’articulent autour de deux axes :
- Méthodologies de synthèse par voie organométallique,
- Chimie médicinale : pharmacochimie dans les domaines de l’oncologie (antivasculaires, anti-angiogéniques, pro-apoptotiques, inhibiteurs de la hsp90, antagonistes PR).

Les membres de l’équipe
Thématiques
Méthodologie de synthèse
La méthodologie de synthèse est basée sur le développement de nouvelles réactions régio et stéréosélectives métallo-catalysées (palladium, platine, Fer…) pour la formation sélective de liaison C-C, C-hétéroatome et C-M (M = étain, bore, silicium…). Ces recherches ont permis de mettre au point des processus de fonctionnalisation d’alcynes de façon régiosélective (hydro- et carbo-métallation, hydratation, oxydation…), des réactions multicomposantes pour obtenir des molécules insaturées et des composés hétérocycliques fonctionnalisés (amines propargyliques, indoles benzofuranes, purines…). Par ailleurs l’activation par micro-ondes est mise à profil pour développer et optimiser certaines des réactions pré-citées.
Chimie médicinale
Les thématiques pharmacochimiques de l’équipe s’articulent autour des antitumoraux, ciblant l’angiogenèse (analogues de la combrétastatine A4, du 2-méthoxy-estradiol…), l’apoptose (flavoquinolones), l’inhibition de la protéine de choc thermique (hsp90) (analogues de la novobiocine, du radicicol…) et les anti-prolifératifs/anti-différenciateurs cellulaires (analogues de la vitamne D3).
- Molécules antitumorales (inhibiteurs de la hsp90, anti-aromatase)
- Molécules antiangiogeniques (antivasculaire, inhibiteurs de VEGF)
- Produits pro-apoptotiques (flavoquinolones)
- Vectorisation et dendrimères
- Processus sélectifs & réactions métallo-catalysées (Pd, Pt, Fe, Sn, Si, B…)
- Chimie hétérocyclique
- Chimie éco-compatible, processus multi-composants, activation micro-onde
- Servier, Merck, Institut Jérôme Lejeune (IJL), ARC, Ligue contre le Cancer, Institut du Médicament…
INSERM-U693 Kremlin-Bicêtre ; INSERM-U773, Bichat ; INSERM-U553, Saint-Louis ; UMR 8612, Châtenay-Malabry ; UMR 6026, Rennes ; UPR2301, Gif-Sur-Yvette ; Université de Québec

Les ANR
CoCaBio
Porteur : LE BIDEAU Franck
Collaborateurs : Françoise Dumas, Samir Messaoudi, Dmytro Ryzhakov, Gaël Printz,* Samuel Dagorne* et Béatrice Jacques*
*Collaboration avec l’UMR7177, Université de Strasbourg
Compte tenu de l’impact environnemental et des pénuries à venir en ressources fossiles, le développement de matériaux obtenus à partir de ressources renouvelables est devenu un enjeu majeur. L’objectif de ce projet est de mettre l’organocatalyse au service de la polymérisation par ouverture de cycle, pour la synthèse de polymères biosourcés. L’approche organocatalytique, qui n’a pas été beaucoup explorée à ce jour, sera complémentaire à court terme, et remplacera à long terme, les méthodes de catalyses organométalliques de façon éco-compatible. Nous développerons la co-polymérisation de dérivés de l’anhydride succinique et d’époxydes issus de ressources renouvelables, via des réactions par ouvertures de cycles. L’anhydride succinique et ses dérivés ont été peu utilisés dans ce domaine, et leurs co-polymérisations avec des époxydes devraient permettre l’accès à de nouveaux matériaux possédant des microstructures à propriétés modulables.
Le projet CoCaBio a été financé par l’ANR (CoCaBio ANR-19HC2503) et par Total (Cellule Energie du CNRS).
NUTS
L’hypertension artérielle pulmonaire (HTAP) est une maladie rare, sévère et incurable, à l’origine d’une défaillance cardiaque droite. Malgré les progrès récents dans la prise en charge thérapeutique, centrée essentiellement sur la correction de la dysfonction endothéliale, il n’existe aucun traitement curatif et la majorité des patients meurent ou bénéficient d’une transplantation pulmonaire dans les 5 ans après le diagnostic. Ce projet dont l’acronyme est NUTS (NMDA receptors Unexpected TargetS in pulmonary arterial hypertension) associe des cliniciens, biologistes, chimistes et structuralistes du LabEx LERMIT (Ce projet multidisciplinaire implique trois partenaires : UMR S-999 P6, CoSMIT-BioCIS UMR 8076 P15 et UMR 8536, P10) et a été sélectionné par l’ANR pour un financement (2015-17).
L’objectif est de concevoir et synthétiser des antagonistes du NMDAR, en tant que nouvelle cible thérapeutique de l’HTAP. Les composés visés : (i) doivent-être actifs et sélectifs vis-à-vis de certaines sous-unités du NMDAR, (ii) ne doivent pas passer la BHE pour une activité périphérique maximale, (iii) doivent cibler les sites inflammatoires à pH abaissé afin de limiter les effets indésirables. Outre une nouvelle facette de la physiopathologie de l’HTAP, ce projet apportera une preuve de concept quant à l’implication des NMDARs dans l’HTAP, en vue du développement d’une nouvelle classe thérapeutique.
CarNuCat : Sucres Nucléophiles, Nouveaux Partenaires dans les Couplages métallocatalysés
Le projet, coordonné par Samir Messaoudi, concernant l’étude de la réactivité des sucres dans les couplages organométallique a été sélectionné par l’ANR dans le cadre de l’appel à projet : Défi de tous les savoirs (DS10) 2015 est financé pour la période de 24 mois.
Le développement de nouvelles stratégies efficaces et stéréosélectives de fonctionnalisation de sucres reste un défi majeur de la communauté des glycochimistes. Dans ce contexte, le but principal de ce projet consiste à développer de nouvelles approches de fonctionnalisation innovantes de la position anomérique de sucres basées sur leur utilisation comme partenaires nucléophiles dans des couplages métallocatalysés (Buchwald-Hartwig-Migita, Ullmann-Goldberg, Chan-Lam-Evans, C-H activation). Ces méthodes permettront de fonctionnaliser une liaison glycosidique (SH, NH2, OH ou C-H) avec un parfait contrôle de la stéréosélectivité indépendamment des groupements protecteurs. De plus, des études mécanistiques seront envisagées si nécessaire, afin de mieux comprendre les paramètres fondamentaux qui gouvernent la réactivité mais aussi la stéréosélectivité de la réaction. Ces méthodes seront appliquées à la synthèse d’hétérosides et de glycoconjugués, outils précieux pour étudier les interactions qui contrôlent les processus biologiques complexes du monde du vivant.
MACHsp90 : « Machinerie de la hsp90 et sa modulation via de nouvelles sondes moléculaires : aspects structuraux, dynamiques et fonctionnels »
Les protéines chaperons jouent un rôle essentiel dans la vie de la cellule, notamment par leur implication dans le processus de repliement des protéines néo-synthétisées. Parmi elles, la protéine de choc thermique de 90 kDa (hsp90) joue un rôle particulier. Dans des conditions normales la hsp90 ne semble pas participer directement au repliement de novo des protéines, mais permet, avec l’aide de cochaperons, à certaines protéines cibles d’acquérir leur conformation active. En condition de stress la hsp90 est surexprimée suggérant un rôle protecteur au niveau cellulaire. Si la hsp90, protéine chaperon, est indispensable au bon fonctionnement de cellules saines, une telle activité représente un inconvénient dans la lutte contre le cancer, car la protection de protéines mutées conduit à la survie de cellules cancéreuses. C’est pourquoi la hsp90 s’est révélée être une cible prometteuse pour de nouvelles stratégies de thérapies anticancéreuses, avec pour objectif d’enrayer simultanément de nombreuses voies d’oncogenèse. La compréhension du cycle de chaperon de la hsp90 constitue par conséquent un défi majeur. Le cycle de la hsp90 est étroitement lié à des changements importants de conformation. Notre compréhension de ces changements repose principalement sur les informations structurales qui se réfèrent aux structures cristallines de la protéine hsp90 recombinante et de son homologue procaryote HtpG. Nous avons récemment publié les premières structures de hsp90 Eucaryote entière observées en l’absence de nucléotide (apo-hsp90), révélant ainsi la flexibilité intrinsèque de cette protéine. Bien que les changements de conformation aient été précédemment attribués à la liaison des nucléotides, nous avons montré qu’ils résultaient de la flexibilité intrinsèque du dimère de hsp90. Ainsi, en tenant compte des propriétés dynamiques du dimère de hsp90, nous avons revu le cycle ATP dépendant de la hsp90. Pour déchiffrer les détails de ce cycle, les inhibiteurs constituent des outils particulièrement intéressants. Dans le cas de la hsp90, il en existe deux types. Les inhibiteurs appartenant à la famille de la geldanamycine, qui sont actuellement les plus étudiés, et ceux dérivant de la novobiocine. Des études récentes ont démontré que chacune de ces deux classes d’inhibiteur agissait de manière différente sur le cycle de chaperonnage de la hsp90. En marquant ces inhibiteurs à des nano particules d’or nous disposerons de sondes moléculaires efficaces qui nous permettrons d’analyser finement le fonctionnement de la hsp90. Le but principal de ce projet est de caractériser les bases moléculaires de l’action des complexe hsp90/cochaperon et de comprendre le mode d’action de la novobiocine et de ses dérivés sur ce système. Afin de pouvoir conduire une étude intégrative de la structure et de la dynamique de la hsp90 au cours de son cycle de chaperonnage, ainsi que des modulations de ce cycle, nous proposons un consortium de quatre équipes, ayant en commun la thématique de recherche sur la protéine hsp90 et associant des compétences complémentaires en pharmaco-chimie, en biologie cellulaire et en biologie structurale. En utilisant les approches structurales les plus modernes tel que la cristallographie au rayon X, la cryo-microscopie électronique ou le procédé CEMOVIS, nous comptons étudier différents complexes formés entre la hsp90, des cochaperons, des protéines cibles et des inhibiteurs de façon a dévoiler les détails du cycle de la hsp90 à la fois au niveau moléculaire et au niveau cellulaire. Les données générées au cours de cette étude seront une contribution majeure pour la compréhension de l’activité oncogène de la hsp90 et devraient permettre le développement et/ou l’optimisation d’inhibiteurs pouvant être utilisés pour traiter des cancers ou des maladies neurodégénératives.
Actualités
Prix de la valorisation de l’Université
Le projet « synthèse d’anticancéreux à effets secondaires amoindris » récompensé au 11e prix de la valorisation [...]
Livres et articles en couverture
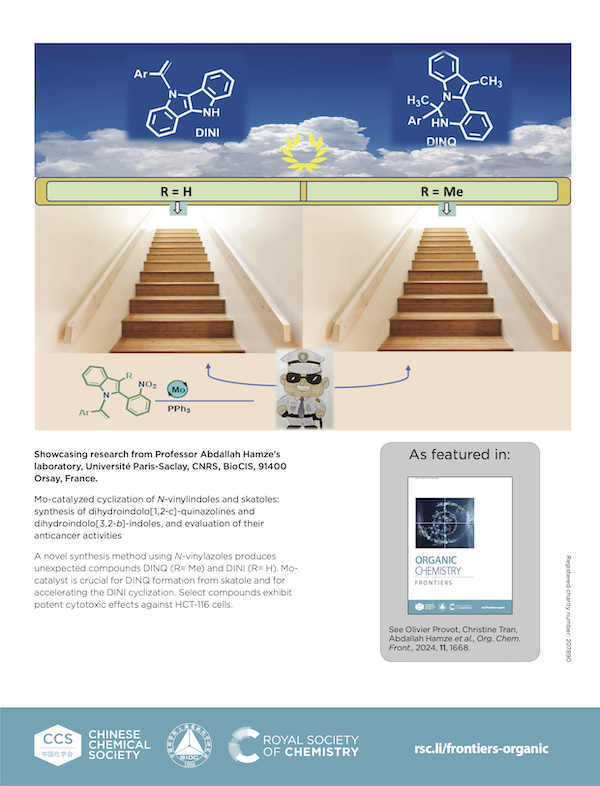
Mo-catalyzed cyclization of N-vinylindoles and skatoles : synthesis of dihydroindolo[1,2-c]-quinazolines and dihydroindolo[3,2-b]-indoles, and evaluation of their anticancer activities
Karine Leblanc2025-04-11T07:24:27+02:004 avril 2024|Catégories : publi-eq2|
A novel synthesis method using N-vinylazoles produces unexpected compounds DINQ (R= Me) and DINI [...]
Production scientifique – CoSMIT
Karine Leblanc2025-05-21T16:00:35+02:007 janvier 2023|Catégories : publi-eq2|
Button Text
Sequential One-Pot Synthesis of 3-Arylbenzofurans from N-Tosylhydrazones and Bromophenol Derivatives
Karine Leblanc2025-04-11T07:23:56+02:004 avril 2020|Catégories : publi-eq2|
The cover art (from CoSMIT team) shows an efficient one-pot sequence, allowing direct access [...]
Metal-Catalyzed Synthesis of 1,1-Diarylethylene
Karine Leblanc2025-04-11T07:23:23+02:004 avril 2017|Catégories : publi-eq2|
The cover picture, provided by Abdallah Hamze and co-workers summarizes the principal methodological studies [...]
N -Tosylhydrazones in Action
Karine Leblanc2025-04-11T07:23:00+02:004 avril 2016|Catégories : publi-eq2|
The cover picture, provided by Abdallah Hamze and co-workers, reports an efficient one-pot metal-catalyzed [...]
Organic : Anticancer compound’s analogues exhibit potent cytotoxicity against cancer cell lines
Karine Leblanc2025-04-11T07:22:50+02:004 mars 2013|Catégories : publi-eq2|
Scientists in France and Lebanon had previously synthesised and evaluated the biological properties of [...]